
A Terceira Lei da Termodinâmica afirma que à medida que uma substância esfria a uma temperatura próxima do zero absoluto (-273,15°C ou 0 Kelvin), sua entropia, que é uma medida da desordem ou incerteza no sistema, aproxima-se de um valor constante e finito. valor.
Esta lei postula que chegar ao zero absoluto exigiria um número infinito de etapas, tornando-o inatingível na prática. Além disso, sugere que todos os sistemas atingiriam um estado de ordem máxima e desordem teórica mínima a essa temperatura extrema, o que tem implicações fundamentais em campos como a física quântica e o estudo de novos materiais com propriedades extraordinárias a temperaturas ultrabaixas.
Abaixo estão alguns exemplos que ilustram esse princípio:
Exemplo 1: Cristais de Gelo
 Quando a água é resfriada a temperaturas muito baixas, próximas do zero absoluto (0 K ou -273,15 °C), as moléculas de água perdem energia cinética e se organizam em uma estrutura cristalina altamente ordenada, formando gelo. Nessas condições, a energia térmica é tão baixa que as moléculas quase não vibram e adotam um arranjo fixo e regular.
Quando a água é resfriada a temperaturas muito baixas, próximas do zero absoluto (0 K ou -273,15 °C), as moléculas de água perdem energia cinética e se organizam em uma estrutura cristalina altamente ordenada, formando gelo. Nessas condições, a energia térmica é tão baixa que as moléculas quase não vibram e adotam um arranjo fixo e regular.
À medida que a temperatura se aproxima do zero absoluto, qualquer desordem térmica residual diminui e os cristais de gelo atingem um estado de ordem máxima, onde a entropia é mínima. Teoricamente, no zero absoluto, não haveria movimento molecular e o sistema estaria no estado de entropia mais baixo possível.
Exemplo 2: Supercondutividade
A supercondutividade é um fenômeno físico que ocorre em certos materiais quando eles são resfriados abaixo de uma temperatura crítica específica. A esta temperatura crítica, os materiais supercondutores apresentam uma propriedade única: a resistência eléctrica desaparece completamente, permitindo que a electricidade flua sem perda de energia.
A Terceira Lei da Termodinâmica explica a relação entre a supercondutividade e a redução da entropia em temperaturas ultrabaixas.
Em condições normais, quando aplicamos uma corrente elétrica através de um condutor, como um fio de cobre, os elétrons que transportam a eletricidade enfrentam obstáculos e colisões com os íons do material, criando resistência ao fluxo de elétrons. Essa resistência é responsável pela perda de energia na forma de calor e limita a eficiência dos dispositivos elétricos.
Porém, em um material supercondutor, em temperaturas muito baixas, próximas do zero absoluto, algo surpreendente acontece: os elétrons formam “pares de Cooper”. Esses pares são compostos de dois elétrons que se ligam e se movem juntos através do cristal sem experimentar resistência.
Exemplo 3: Hélio Líquido
 O hélio é um gás inerte à temperatura ambiente, mas em temperaturas extremamente baixas, próximas do zero absoluto, apresenta um comportamento fascinante e único. Quando resfriado o suficiente, abaixo de 4,2 K, o hélio não solidifica como outros gases, mas se torna líquido.
O hélio é um gás inerte à temperatura ambiente, mas em temperaturas extremamente baixas, próximas do zero absoluto, apresenta um comportamento fascinante e único. Quando resfriado o suficiente, abaixo de 4,2 K, o hélio não solidifica como outros gases, mas se torna líquido.
À medida que o hélio esfria e se transforma em líquido, os átomos de hélio perdem energia térmica, reduzindo sua agitação e mobilidade. Essa diminuição na energia cinética dos átomos resulta em uma redução significativa na entropia. Em temperaturas ainda mais baixas, o hélio exibe propriedades quânticas, como superfluidez, onde flui sem qualquer atrito.
À medida que o sistema se aproxima do zero absoluto, aproxima-se de um estado de ordem quase perfeita, onde a entropia tende ao seu mínimo.
Exemplo 4: Condensados de Bose-Einstein
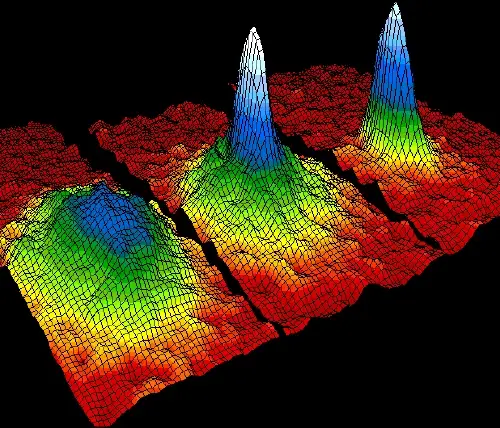 Em temperaturas próximas do zero absoluto, alguns átomos se unem em um estado especial de agregação denominado condensado de Bose-Einstein.
Em temperaturas próximas do zero absoluto, alguns átomos se unem em um estado especial de agregação denominado condensado de Bose-Einstein.
Neste estado quântico, os átomos perdem sua individualidade e se comportam como uma entidade quântica única. Este fenômeno é possível graças à Terceira Lei da Termodinâmica, que afirma que a entropia diminui à medida que são atingidas temperaturas extremamente baixas.
Este fenômeno foi previsto por Albert Einstein e pelo físico indiano Satyendra Nath Bose na década de 1920. A ideia é baseada na estatística quântica de Bose-Einstein, que descreve o comportamento de partículas idênticas e indistinguíveis, como fótons de luz ou os átomos que constituem certas partículas. elementos.
Em condições normais, em temperaturas mais altas, as partículas seguem uma distribuição estatística de Fermi-Dirac (para férmions) ou Maxwell-Boltzmann (para bósons).
No entanto, quando as partículas são arrefecidas a temperaturas extremamente baixas, o seu comportamento quântico colectivo começa a dominar, e elas tendem a “colapsar” para o estado de energia mais baixo possível. Neste ponto, um grande número de partículas ocupa um único estado quântico, formando o que é conhecido como condensado de Bose-Einstein.
Nesse estado quântico, as partículas perdem a individualidade e se comportam como uma “superpartícula” coletiva, com propriedades quânticas macroscópicas. Toda a substância se torna uma única entidade quântica
Exemplo 5: Hélio Sólido
 Em temperaturas próximas do zero absoluto, o hélio líquido também pode solidificar. No seu estado sólido, o hélio apresenta um comportamento incomum, como a superfluidez, onde pode fluir sem resistência através de capilares extremamente estreitos, desafiando as leis clássicas da física.
Em temperaturas próximas do zero absoluto, o hélio líquido também pode solidificar. No seu estado sólido, o hélio apresenta um comportamento incomum, como a superfluidez, onde pode fluir sem resistência através de capilares extremamente estreitos, desafiando as leis clássicas da física.
Exemplo 6: Gelo seco
 O gelo seco é dióxido de carbono (CO₂) em estado sólido a temperaturas muito inferiores ao ponto de congelamento da água. Ao contrário da água, que congela a 0°C, o CO₂ solidifica diretamente em gelo seco a uma temperatura de -78,5°C (-109,3°F) à pressão atmosférica normal.
O gelo seco é dióxido de carbono (CO₂) em estado sólido a temperaturas muito inferiores ao ponto de congelamento da água. Ao contrário da água, que congela a 0°C, o CO₂ solidifica diretamente em gelo seco a uma temperatura de -78,5°C (-109,3°F) à pressão atmosférica normal.
Quando o gelo seco está a temperaturas próximas do zero absoluto, ele se comporta de forma semelhante a outros sólidos nessas temperaturas extremamente baixas. As moléculas de CO₂ que formam o gelo seco reduzem drasticamente a sua energia cinética, resultando numa estrutura altamente ordenada e numa diminuição significativa da entropia. Neste estado, o gelo seco atingiria o seu arranjo térmico máximo possível à temperatura ambiente.
O gelo seco é amplamente utilizado em aplicações como refrigerante, na indústria alimentícia, no transporte de materiais sensíveis ao calor e como efeito especial na indústria de teatro e entretenimento.