Dentre as leis fundamentais que regem a termodinâmica, a lei zero ocupa um lugar crucial, pois estabelece os conceitos fundamentais de temperatura e equilíbrio térmico.
A lei zero da termodinâmica afirma que “se dois sistemas estão em equilíbrio térmico com um terceiro sistema, eles também estão em equilíbrio entre si”. Também é conhecido como princípio zero da termodinâmica.
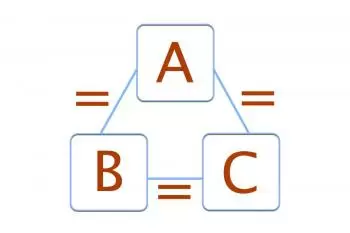
Se A está em equilíbrio com B e A também está em equilíbrio térmico com um terceiro corpo C, podemos concluir que B está em equilíbrio térmico com C.
Dois corpos estão em equilíbrio térmico quando, ao entrarem em contato, suas variáveis de estado não mudam. Se não estiverem em equilíbrio térmico, sofrerão uma troca de calor ou energia e atingirão o equilíbrio térmico.
A lei zero foi a última das leis da termodinâmica a ser introduzida. Para obter uma estrutura lógica, foi necessário colocá-la antes das demais leis.
Fórmula da 0ª lei da termodinâmica
Princípio 0 da termodinâmica, se os três sistemas estão em equilíbrio térmico, a seguinte fórmula deve ser completada:
TA = TB = TC
Onde TA , TB e TC são as temperaturas dos três sistemas.
Origem e história da lei zero
A lei zero da termodinâmica foi formulada como uma resposta a questões sobre medição e comparação de temperaturas. Antes do seu estabelecimento, as escalas de temperatura eram arbitrárias e dependiam de métodos de medição específicos. A necessidade de uma base mais sólida para comparar temperaturas foi um tema quente na comunidade científica do século XIX.
Foi o físico alemão Gustav H. Johannsen quem primeiro formulou a ideia central da lei zero na década de 1860, mas foi somente na década de 1930 que ela foi consolidada e incorporada como uma lei fundamental da termodinâmica.
A lei zero é assim chamada porque fornece a base para a construção de escalas de temperatura e estabelece um princípio fundamental para a medição da temperatura.
Exemplos da lei zero
Para entender como funciona a lei zero da termodinâmica, propomos três exemplos:
Gelo e água
Colocamos um pedaço de gelo e um copo cheio de água em temperatura ambiente. Neste experimento aparecem três elementos: o gelo, a água e o copo.
Inicialmente os três trocarão calor e energia até atingir o equilíbrio térmico. Depois de um tempo, os três elementos atingirão a mesma temperatura
Copos de café
Vamos imaginar duas xícaras de café, uma quente e outra fria. Quando entram em contato, o calor flui do copo quente para o copo frio até que ambos atinjam a mesma temperatura e estejam em equilíbrio térmico.
Este é um exemplo prático do princípio zero em ação: os dois sistemas estão em equilíbrio térmico quando não há mais transferência líquida de calor entre eles.
Exemplo de termômetro
Outro exemplo que ajudará a compreender melhor o conceito de equilíbrio térmico é o do termômetro.
Considere um corpo B que consiste em um tubo com um capilar contendo mercúrio. Seus níveis de altura acima do capilar representam diferentes temperaturas.
Agora, considere um corpo A, por exemplo o corpo humano. Se você aproximar o termômetro do corpo e deixá-lo por tempo suficiente, o termômetro atingirá o valor correspondente à temperatura do seu corpo.
O termômetro e o corpo humano estarão em equilíbrio térmico entre si. Portanto, ambos os elementos atingem a mesma temperatura.