Na termodinâmica, um processo isobárico é uma mudança no estado de uma certa quantidade de matéria na qual a pressão permanece constante . O que muda é uma ou mais de suas variáveis de estado, como volume e temperatura. Se o calor for transferido para o sistema, o trabalho será realizado e a energia interna do sistema também mudará.
O processo isobárico para gases ideais segue a lei de Charles. De acordo com esta lei, para uma massa fixa de gás ideal a pressão constante, o volume é diretamente proporcional à temperatura em Kelvin.
Os processos isobáricos são regidos pela primeira lei da termodinâmica. Nestes processos, o aumento da entalpia (ΔH) é igual ao calor transferido ao sistema, e o trabalho realizado é P·ΔV. A relação entre energia interna, trabalho e calor é expressa como ΔU=Q−PΔV, com Q=ΔH.
Definição de um processo isobárico
Um processo isobárico é aquele em que a pressão permanece constante enquanto o sistema sofre outras alterações. Em termos mais técnicos, diz-se que a derivada da pressão em relação ao tempo é igual a zero, ou seja:
dP/dt=0
Esse tipo de processo difere de outros processos termodinâmicos, como processos isocóricos (nos quais o volume é constante), processos isotérmicos (nos quais a temperatura é constante) e processos adiabáticos (nos quais não há transferência de calor).
Embora a pressão permaneça constante, outras propriedades do sistema, como volume e temperatura, podem mudar. À medida que o volume do sistema muda, o trabalho é realizado, e esse trabalho está relacionado à mudança no volume sob pressão constante.
Exemplos de processos isobáricos
Para compreender melhor este processo termodinâmico, será útil ver alguns exemplos.
-
Fase de expansão de um cilindro do motor.
-
Água fervente em um recipiente aberto.
-
Aquecimento de um globo devido aos efeitos da radiação solar.
Aquecendo o ar em um balão
A mudança no volume que um balão experimenta quando os raios solares o atingem é um exemplo de processo isobárico.
No início da manhã apresenta certa pressão, volume e temperatura À medida que o ar em seu interior aquece, a pressão aumenta, mas não varia devido ao aumento do seu volume.
Fase de expansão do cilindro de uma máquina térmica
A expansão do ar em um cilindro com pistão móvel ao qual é fornecido calor é realizada por um processo isobárico.
O volume aumentará proporcionalmente à sua temperatura e a pressão permanecerá constante. Isto está de acordo com a lei de Charles.
Ferver água em um recipiente aberto
Um exemplo cotidiano de processo isobárico ocorre quando água ferve em um recipiente aberto. Ao fornecer energia térmica à água, ela aumenta de temperatura e se transforma em vapor.
O vapor obtido tem temperatura mais elevada e ocupa maior volume, porém a pressão permanece constante. Desde o início a pressão é igual à pressão atmosférica.
Lei dos gases ideais e processos isobáricos
Para compreender completamente os processos isobáricos, é útil considerar a equação de estado do gás ideal , que estabelece uma relação entre pressão (P), volume (V), temperatura (T) e a quantidade de gás (n) em mols, de acordo com para a equação:
P·V=n·R·T
Onde R é a constante do gás ideal. Num processo isobárico, a pressão P é constante; Isto implica que, sob condições de pressão constante, o volume de um gás ideal é diretamente proporcional à sua temperatura.
Se a temperatura de um gás aumentar num processo isobárico, o seu volume também aumentará proporcionalmente, e se a temperatura diminuir, o volume diminuirá.
Essa relação é uma forma da lei de Charles, que é um caso particular da lei dos gases ideais para um processo isobárico.
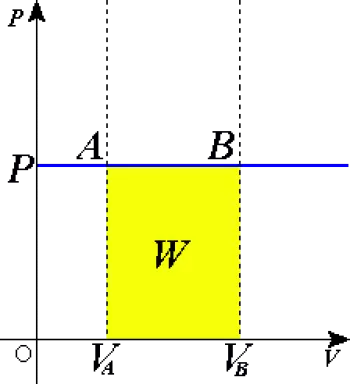
Trabalho realizado em um processo isobárico
 Um dos aspectos mais importantes dos processos isobáricos é o trabalho realizado por ou no sistema durante o processo.
Um dos aspectos mais importantes dos processos isobáricos é o trabalho realizado por ou no sistema durante o processo.
Num processo termodinâmico, o trabalho realizado pelo sistema é definido como:
W=∫P·dV
Num processo isobárico, onde a pressão é constante, esta equação é simplificada para:
W=P·ΔV
Onde ΔV é a mudança no volume do sistema. Se o volume aumentar, o sistema realiza trabalho nas vizinhanças, o que significa que o gás está se expandindo. Se o volume diminuir, a vizinhança atua no sistema, comprimindo o gás.
Este trabalho realizado está intimamente ligado à variação da energia interna e ao calor adicionado ou retirado do sistema, conforme a segunda lei da termodinâmica, que afirma:
ΔU=Q−W
Onde:
- ΔU é a mudança na energia interna do sistema.
- Q é o calor adicionado ao sistema.
- W é o trabalho realizado pelo sistema.
Num processo isobárico, o calor adicionado ao sistema não só altera a energia interna do sistema, mas também é convertido em trabalho devido à mudança no volume. Esta característica é diferente de um processo isocórico, onde todo o calor adicionado é convertido em energia interna, uma vez que nenhum trabalho é realizado num sistema de volume constante.